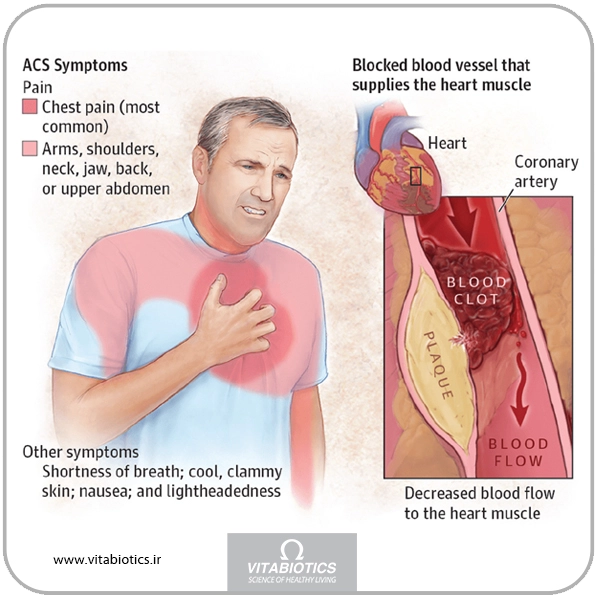
در هر 34 ثانیه یک آمریکایی دچار یک رویداد قلبی میشود. برای پزشکان مراقبتهای اولیه مهم است که قادر به تشخیص و مدیریت سندرم کرونری حاد (ACS) باشند که شامل دو تظاهر بالینی است:
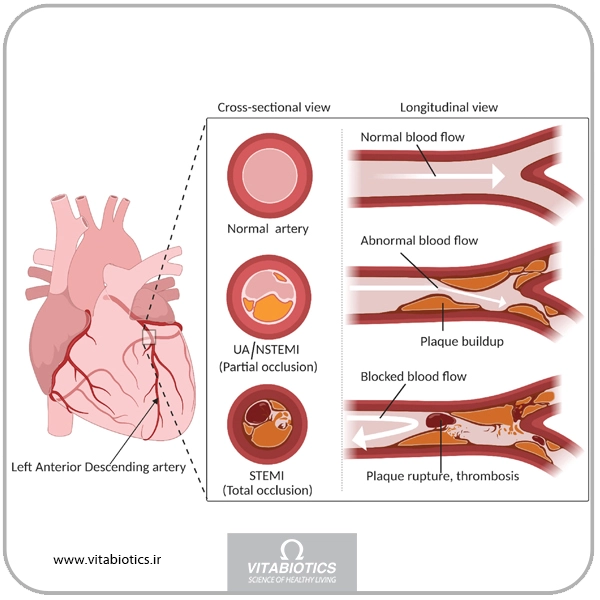
1. انفارکتوس میوکارد با بالا رفتن قطعه ST (STEMI)
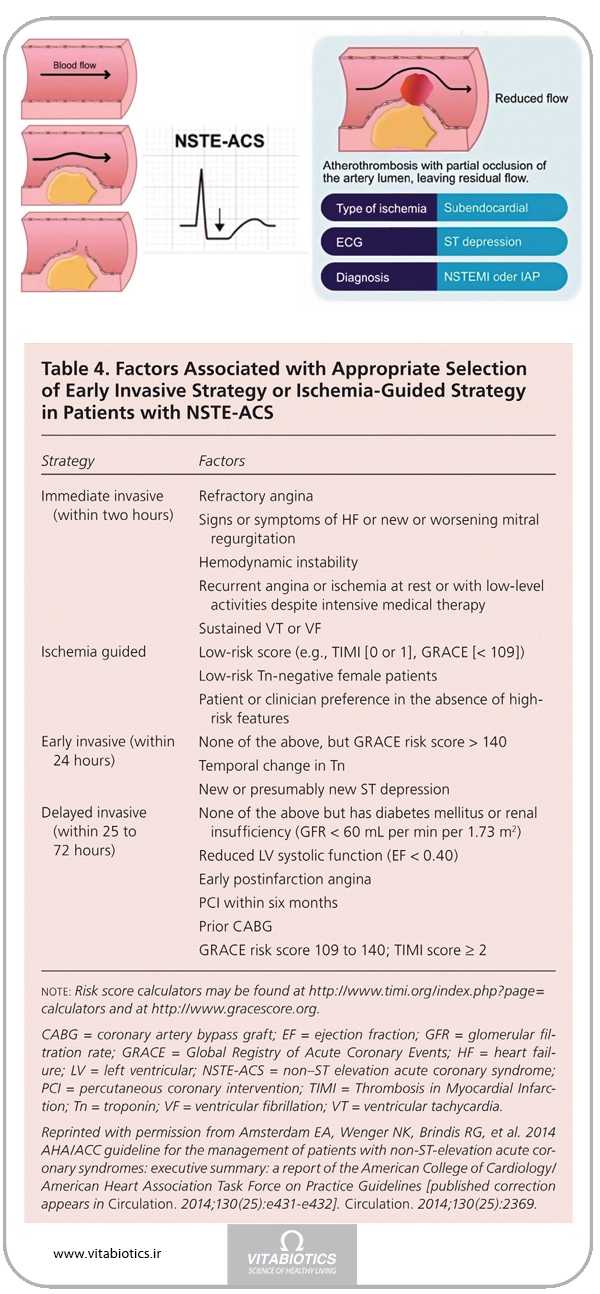
2. بحاد عروق کرونری بدون بالا رفتن قطعه ST (ACS-NSTE). واژه انفارکتوس حاد میوکارد بدون بالا رفتن قطعه ST یا (NSTEMI) دیگر در گایدلاینهای کالج آمریکایی قلب آمریکا/انجمن قلب آمریکا (AHA/ACC) بهعنوان یک مقوله گسترده با دستورالعملهای درمانی جداگانه مورد استفاده قرار نمیگیرد. بهجای این موارد، تظاهرات ACS که منجر به بالا رفتن قطعه ST نمیشود، با هم ترکیب شده و بهعنوان ACS-NSTE، از جمله NSTEMI و آنژین ناپایدار معرفی میشوند.
از سال 2010، بیش از 625,000 بیمار هر ساله با تشخیص ACS از بیمارستانهای ایالات متحده مرخص شدند. مطالعه GRACE نشان داد که تقریباً 30 درصد از بیماران مبتلا به ACS دارای STEMI بودند، در حالیکه 70 درصد از بیماران مبتلا به نوع NSTE بودند. سن متوسط در زمان بروز اولین انفارکتوس میوکارد (MI) 65 سال در مردان و 72 سال در زنان است. هرچند که شواهدی دال بر کاهش میزان مرگ و میر در بیمارانی که تحت درمان مناسب قرار دارند وجود دارد، ACS همچنان شایعترین علت مرگ در ایالات متحده است.
این مقاله روی درمان ACS بر اساس گایدلاینهای کالج بنیاد آمریکایی کاردیولوژی/AHA برای مدیریت STEMI و گایدلاین AHA/ACC برای مدیریت NSTE-ACS تمرکز دارد.
پیش گیری اولیه سندروم کرونری حاد
دستورالعملهای AHA/ACC بر اهمیت پیشگیری اولیه از ACS با کاهش عوامل خطر بیماریهای عروق کرونر، از جمله فشارخون، کلسترول، دیابت و سیگار کشیدن تأکید دارند. تاریخچه خانوادگی بیماری عروق کرونری نیز یک ریسک فاکتور است.
چندین خطر وجود دارد که مهمترین آنها امتیاز خطر Framingham و اخیراً Pooled Cohort Equations برای بیماریهای قلبی عروقی آترواسکلروتیک هستند.
با این حال، این روش برای تخمین بیش از حد خطر بیماری قلبی و عروقی در بزرگسالان بدون دیابت مورد انتقاد است. پزشکان خانواده باید به بیماران درباره عوامل خطر، تظاهرات بالینی و علائم ACS آموزش دهند.
افراد مسنتر، افراد مبتلا به دیابت، زنان و بیماران پس از عمل باید آگاه باشند که ممکن است علائم و تظاهرات آتیپیک ACS را داشته باشند. به بیماران در معرض خطر به طور منظم توصیه میشود که در صورت بروز علائم غیرمعمول بلافاصله به دنبال مراقبتهای پزشکی باشند.
مدیریت اولیه سندرم کرونری حاد
در سطح فردی، در اولین تشخیص علائم ACS، بیماران باید یک آسپرین بدون پوشش یا 162 تا 325 میلیگرم (coated enteric-non) را بجوند، مگر اینکه سابقه حساسیت شدید به آسپرین داشته باشند. در سطح جامعه، مناطق محلی باید سیستمهای خدمات اورژانس پزشکی را که مراقبت از STEMI را پشتیبانی میکنند، ایجاد و نگهداری کنند.
بیشتر بخوانید : علت سردی پا
مراقبت اولیه باید شامل ارزیابی کامل علائم بالینی و عوامل خطر بیماری عروق کرونر و همچنین الکتروکاردیوگرافی 12 لیدی باشد.
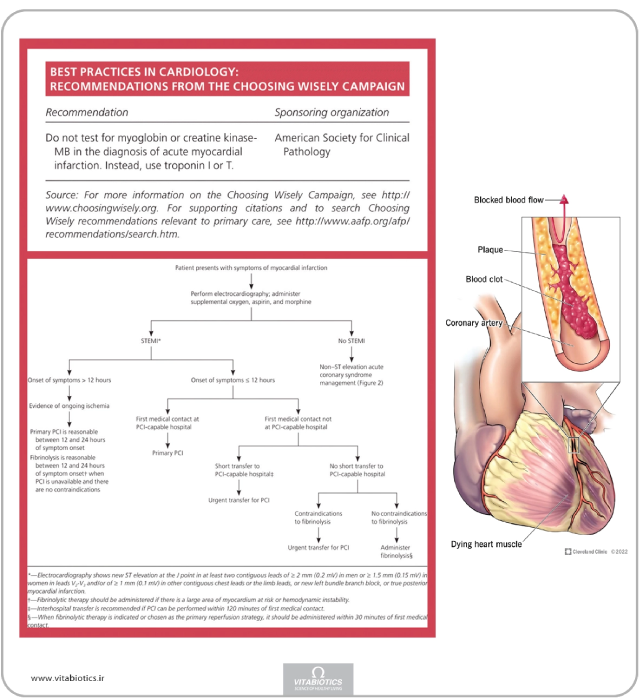
یافتههای الکتروکاردیوگرام ممکن است منعکسکننده ایسکمی میوکارد باشد که شامل تغییرات در بخش PR، مجموعه QRS و بخش ST است. بخشی از ارزیابی اولیه همچنین شامل بررسی بیومارکرهای قلبی است که شامل تروپونین (I یا T) است. مداخله کرونری اولیه از راه پوست (PCI) روش توصیهشده برای باز کردن مجدد عروق است؛ بنابراین، تمام تلاشها باید برای انتقال بیمار مشکوک به STEMI به یک بیمارستان واجد شرایط PCI انجام شود.
اگر هیچ مرکزی در یک فاصله زمانی 30 دقیقهای در دسترس نباشد، مدیریت پزشکی باید در نزدیکترین بخش اورژانس انجام شود. هدف از مدیریت پزشکی، تجویز درمان فیبرینولیتیک در عرض 30 دقیقه از اولین تماس با پزشک است.
مدیریت دارویی سندرم حاد کرونری
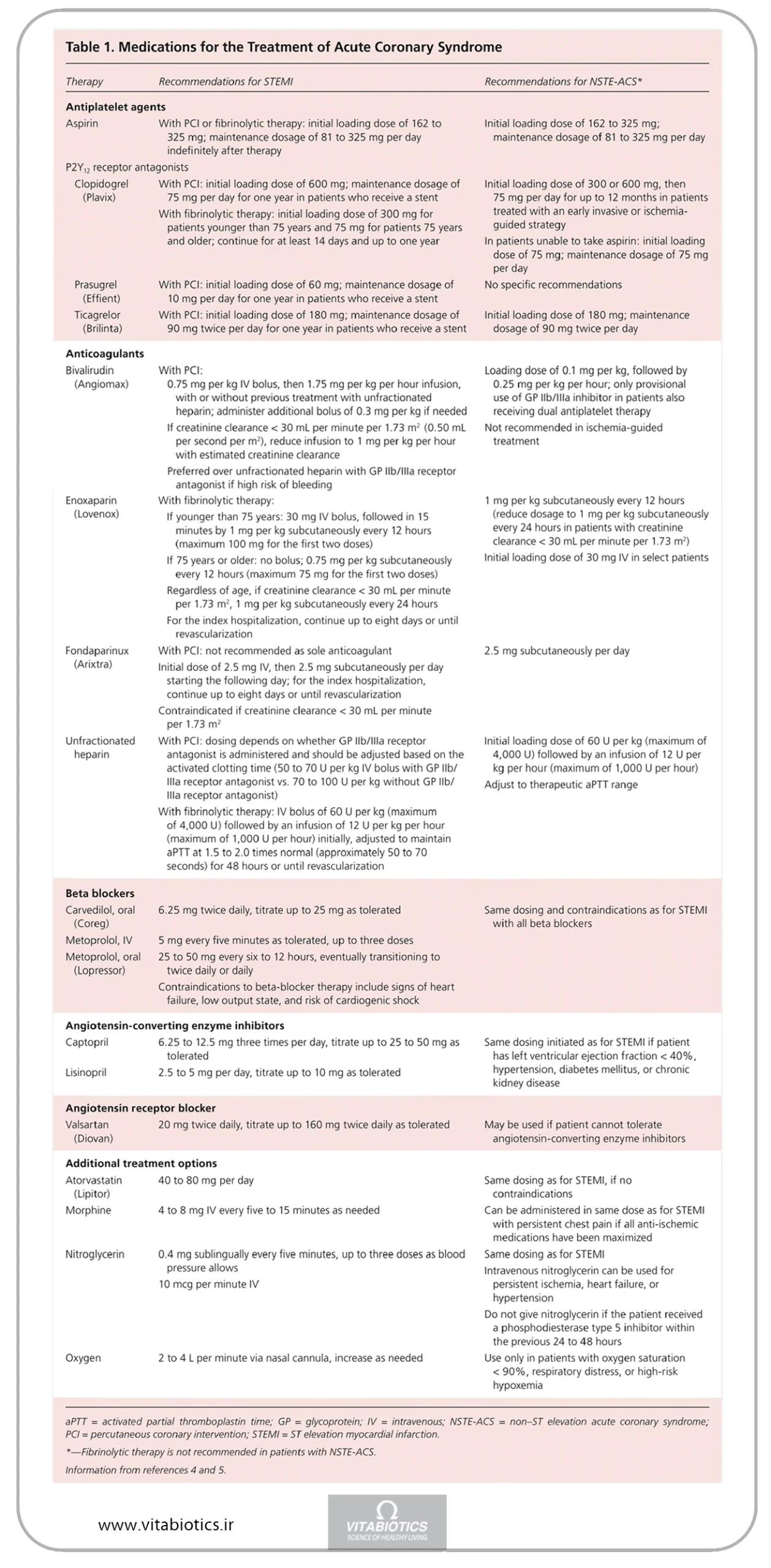
در جدول 1 داروهای مورد استفاده برای مدیریت ACS خلاصه شده است. درمان آنتی پلاکت دوگانه در درمان STEMI برای حمایت از PCI اولیه و استراتژیهای درمانی فیبرینولیتیک بسیار توصیه میشود.
با هر یک از استراتژیها، آسپرین درمانی (162 تا 325 میلیگرم در روز) باید در اسرع وقت شروع شود و بهطور نامحدود ادامه یابد. برای بیماران تحت PCI اولیه برای STEMI، یک آنتاگونیست گیرنده P2Y12 مانند کلوپیدوگرل (Plavix، 600 میلیگرم) باید در اسرع وقت یا در زمان PCI تجویز شود و دوز نگهداری 75 میلیگرم در روز باید برای یک سال در بیماران دریافتکننده است ادامه یابد.
بیماران تحت فیبرینولیز برای STEMI باید دوز بارگیری کلوپیدوگرل (300 میلیگرم در افراد کمتر از 75 سال یا 75 میلیگرم در افراد 75 سال و بالاتر) را قبل از درمان دریافت کنند. کلوپیدوگرل 75 میلیگرم در روز، باید در بیماران تحت درمان فیبرینولیتیک برای حداقل 14 روز و تا یک سال ادامه یابد.
مهارکنندههای گلیکوپروتئین IIIa/IIb (مانند تیروفیبانیا eptifibatide ،Aggrastat یا Integrilin و abciximab یا Reopro) هنگام استفاده در طول PCI در افرادی که دارای STEMI هستند، مفید است و همچنین بهعنوان درمان کمکی PCI در افرادی که دارای ACS-NSTE هستند، مزایایی را نشان داده است. با این حال، درمان ضدترومبوتیک سهگانه با افزایش خطر خونریزی همراه است.
درمان ضد انعقادی باید با درمان PCI یا فیبرینولیتیک برای درمان STEMI نیز آغاز شود. برای بیماران تحت PCI، باید هپارین شکسته نشده برای نگهداری سطح زمان فعال لخته شدن درمانی تجویز شود. Bivalirudin یا Angiomax یک گزینه است، حتی با استفاده قبلی از هپارین شکسته نشده. Fondaparinux یا Arixtra نباید بهعنوان درمان ضد انعقادی تنها در بیماران تحت PCI، به علت خطر ترومبوز کاتتر، مورد استفاده قرار گیرد. برای بیماران دریافتکننده فیبرینولیتیک برای STEMI، میتوان از enoxaparin یا Lovenox، یا fondaparinux استفاده کرد. درمان باید حداقل 48 ساعت و حداکثر هشت روز ادامه یابد.
گزینههای اضافی درمان حاد شامل اکسیژن مکمل، نیتروگلیسیرین، مورفین داخل وریدی، بتا بلوکرها، مهارکنندههای آنزیم تبدیلکننده آنژیوتانسین یا مسدودکنندههای گیرنده آنژیوتانسین و استاتینها هستند.
بیشتر بخوانید : هپاتیت ویروسی در بارداری
این داروها ممکن است برای STEMI یا ACS-NSTE استفاده شوند، اما با چند تفاوت اندک که در جدول 1 مشخص شده است. اطلاعات محدودی برای پشتیبانی یا رد استفاده منظم از اکسیژن مکمل در مدیریت مرحله حاد وجود دارد. اکسیژن مکمل ممکن است افزایش مقاومت عروق کرونری را به همراه داشته باشد، اگرچه ممکن است در بیماران با اشباع اکسیژن کمتر از 90 درصد مناسب باشد.
مورفین همچنان داروی انتخابی برای کاهش درد در بیماران با STEMI است؛ با این حال، باید در بیماران مبتلا به ACS-NSTE فقط در صورتی استفاده شود که درمان ضدایسکمی به حداکثر برسد و درد قفسه سینه باقی بماند. مسدودکنندههای بتا باید در عرض 24 ساعت در بیماران مبتلا به STEMI یا ACS-NSTE آغاز شود که علائم نارسایی قلبی، شواهدی از وضعیت خروجی پایین، افزایش خطر ابتلا به شوک کاردیوژنیک و یا سایر موارد منع مصرف را نداشته باشند. مهارکنندههای آنزیم تبدیل آنژیوتانسین باید در عرض 24 ساعت اول برای تمام بیماران مبتلا به نارسایی قلبی، STEMI با محل آنتریور و یا کسر جهشی کمتر از 40 درصد، در صورت عدم وجود منع مصرف درمانی، تجویز شود. حتی در بیماران با سطح پایه پایین کلسترول لیپوپروتئین با چگالی کم (کمتر از 0.7 میلیگرم در دسیلیتر)، استاتین درمانی با شدت شدید توصیه میشود. رپرفیوژن درمانی پس از تشخیص STEMI، مناسبترین استراتژی برای رپرفیوژن باید به سرعت تعیین شود.
رپرفیوژن درمانی سندروم حاد کرونری
باید به بیماران واجد شرایط مبتلا به STEMI و وقوع نشانهها در طول 12 ساعت قبل از اعمال شود. شکل 1 عناصر درگیر را در ایجاد یک استراتژی درمانی برای بیماران مبتلا به STEMI خلاصه میکند.
برقراری سریع جریان در شریان مسدود مهمترین عامل در تعریف پیامدهای کوتاه و بلندمدت، صرفنظر از روش، است.
PCI اولیه، در مقایسه با فیبرینولیز، زمانی که در یک مرکز درمان مجهز و بدون تأخیر درمانی انجام شود، باعث بهبود پیامدهای بیمار میشود. با این حال، اگر اولین تماس پزشکی بیمار در یک مرکز غیر از PCI باشد و اگر این درمان با تأخیر انجام شود، این مزیت نسبی از بین میرود؛ بنابراین، بدون توجه به استراتژی، تأکید باید بر روی رپرفیوژن سریع باشد.
در بیماران مبتلا به STEMI که تحت PCI قرار میگیرند، اهداف توصیهشده برای اولین تماسهای پزشکی تا زمان دستگاه 90 دقیقه برای افرادی که به بیمارستان مجهز به PCI میرسند و 120 دقیقه برای افرادی که به بیمارستانی که دارای PCI نیستند، رسانده میشوند. PCI به عنوان اولین روش رپرفیوژن در نظر گرفته میشود، مگر اینکه بیمار دارای کنترااندیکاسیون مطلق باشد.
اگر اولین تماس پزشکی در یک بیمارستان بدون تجهیزات PCI باشد، انتخاب یک استراتژی رپرفیوژن نیاز به بررسی چند عامل دارد، از جمله زمان لازم برای انتقال، زمان شروع علائم STEMI، خطر عوارض ناشی از STEMI، خطر خونریزی با فیبرینولیز و وجود شوک یا نارسایی قلب.
در صورت عدم وجود کنترااندیکاسیون، باید در بیمارانی که مبتلا به STEMI در بیمارستانهای غیرمجاز به PCI هستند، در صورتی که پیشبینی اولین زمان تماس پزشکی با زمان دستگاه در بیمارستان مجهز به PCI بیشتر از 120 دقیقه باشد، تجویز شود. کنترااندیکاسیونهای مطلق و نسبی را برای درمان فیبرینولیتیک بازگو میکند.
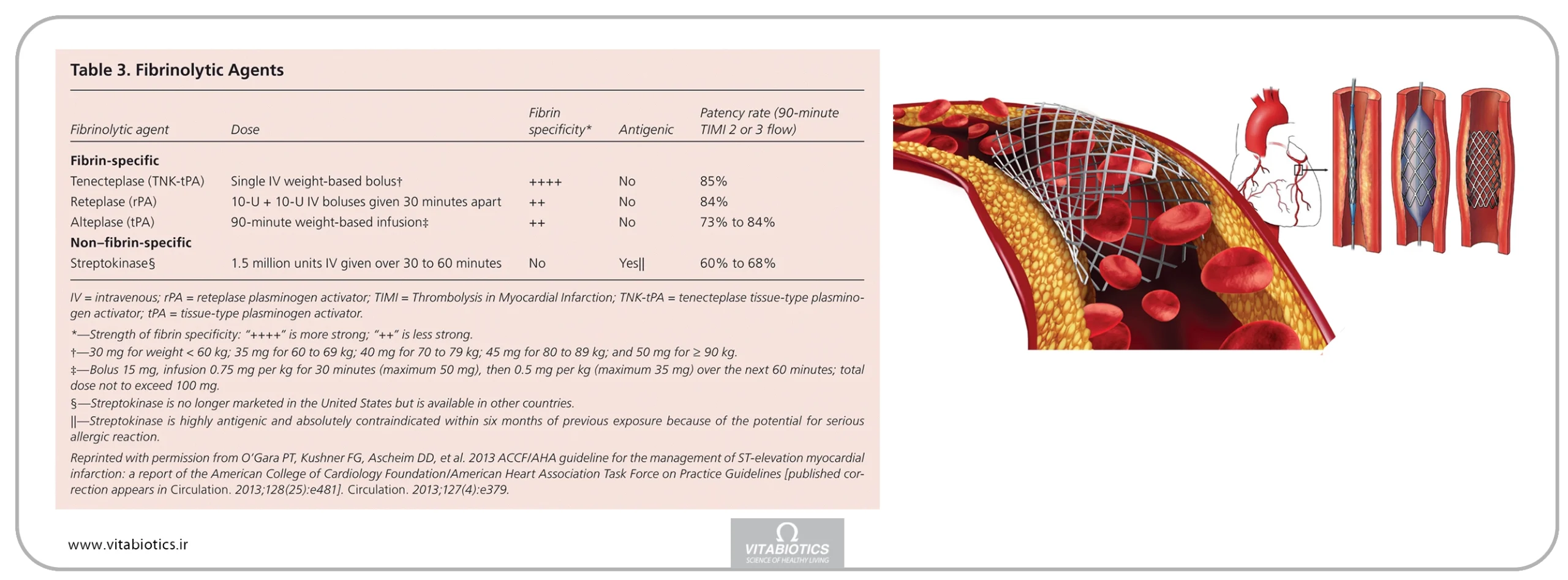
دستورالعمل AHA/ACCF توصیه میکند که یک عامل فیبرینولیتیک مخصوص فیبرین استفاده شود. جدول 3 لیست عوامل فیبرینولیتیک موجود را برمیشمارد. تمام این عوامل که در ایالات متحده موجود هستند، به عنوان فیبرین خاص شناخته میشوند. انتقال به بیمارستان مجهز به PCI برای آنژیوگرافی برای همه بیماران مبتلا به STEMI پس از فیبرینولیز توصیه میشود، اگرچه فوریت انتقال بستگی به وضعیت بالینی بیمار دارد.
انتقال سریع برای بیمارانی توصیه میشود که پس از فیبرینولیز دچار شوک قلبی یا نارسایی قلبی حاد شدید شدهاند. حتی در صورت عدم وقوع شوک یا نارسایی قلبی در بیمارانی که با شکست در انجام رپرفیوژن یا برطرف کردن انسداد شدهاند، انتقال فوری برای آنژیوگرافی توصیه میشود.
توجه ویژه باید برای زنان مبتلا به STEMI انجام شود، زیرا آنها پاسخ بهتری به PCI نسبت به فیبرینولیز نشان دادهاند. درمان فیبرینولیتیک بهترین گزینه بعدی است.
شواهد شکست در انجام رپرفیژن شامل عدم برگشت ST بالا رفته به خط پایه و تداوم درد قفسه سینه یا بازگشت آن است. انتقال معمول به بیمارستان مجهز به PCI برای آنژیوگرافی پس از فیبرینولیز موفقیتآمیز نشان داده شده که پیامدها را در کارآزماییهای متعدد بهبود بخشیده و توصیه میشود، ایده آل آن است که انتقال طی 24 ساعت انجام فیبرینولیز شود.